- (от лат. ad - на, при и sorbeo - поглощаю), процесс, приводящий к аномально высокой концентрации в-ва (а д с о р б а т а) из газообразной или жидкой среды на поверхности её раздела с жидкостью или тв. телом (а д с о р б е н т о м). Частный случай сорбции. Физический энциклопедический словарь
Адсорбция Движущей силой
Веществ на поверхности.
Физическая адсорбция. Адсорбированный слой связан с поверхностью слабыми межатомными связями, например силами Ван-дер-Ваальса. Теплота физической адсорбции, как правило, невелика и редко превосходит несколько десятков кДж/моль (примерно 40 кДж/моль). Процесс физической адсорбции обратим, относится к неактивируемым, протекает очень быстро, как только молекулы адсорбата окажутся на поверхности твёрдого или жидкого тела. Наиболее часто физическую адсорбцию связывают с взаимодействием поверхности с газовой фазой. Количество адсорбированного газа снижается при уменьшении давления и возрастании температуры.
| , | (2.4) |
к Р
Р

(а) и температуры (б ) (пояснения в тексте)
| , | (2.5) |
где а к в уравнении (2.5).
Процесс адсорбции почти всегда сопровождается выделением теплоты, которое называют теплотой адсорбции. Прочность адсорбционного слоя пропорциональна теплоте адсорбции.
На рисунке 2.1, б
Химическая адсорбция. Хемосорбция представляет собой процесс поглощения поверхностью жидкого или твердого тела веществ из окружающей среды, сопровождающийся образованием химических соединений. При хемосорбции выделяется значительное количество теплоты. Обычно теплоты хемосорбции лежат в пределах 80–125 кДж/моль. Взаимодействие кислорода с металлами (окисление) даёт значительно более высокие значения теплоты, достигающие 400 кДж/моль.
ПОСМОТРЕТЬ ЕЩЕ:
Адсорбция в химии
Введение
Адсорбцией называют процесс поглощения вещества из смеси газов, паров или растворов поверхностью или объемом пор твердого тела — адсорбента.
Явление адсорбции известно очень давно. Такие природные материалы, как песок и почва, использовали для очистки воды еще на заре человеческого общества. В конце XVIII века К. Шееле и одновременно Фонтана обнаружили способность свежепрокаленного древесного угля поглощать различные газы в объемах, в несколько раз превышающих его собственный объем. Вскоре выяснилось, что величина поглощенного объема зависит от типа угля и природы газа. Т.Е. Ловиц в 1785 году открыл явление адсорбции углем в жидкой среде, подробно исследовал его и предложил использовать уголь для очистки фармацевтических препаратов, спирта, вина, органических соединений. Ловиц показал, что древесный уголь способен быстро очищать испорченную воду и делать ее пригодной для питья. И сейчас основным действующим началом фильтров для воды служат углеродные материалы, конечно более современные, чем природные угли. Адсорбция отравляющих веществ из воздуха была использована Н.Д. Зелинским при создании противогаза во время первой мировой войны.
Адсорбция газов на твердых поверхностях используется в некоторых отраслях пищевой промышленности, а именно масложировой (например, в производстве маргарина) и в бродильной (например, в производстве дрожжей) для очистки технологических газовых потоков с целью предотвращения выбросов вредных веществ в атмосферу. Поглощение паров воды происходит на пористых веществах, которые выполняют роль твердого адсорбента. Подобные процессы наблюдаются в отношении сахара, соли и сухарей.
Адсорбция, ее виды
Адсорбционный способ регулирования газового состава хранилищ скоропортящихся продуктов позволяет в несколько раз сократить потери и увеличить сроки хранения. Адсорбция различных пищевых кислот, лимонной в частности, снижает по сравнению с водой поверхностное натяжение большинства прохладительных напитков. Адсорбция веществ на поверхности раздела жидкость — газ способствует устойчивости пен. Подобный процесс имеет место в бродильной промышленности при производстве дрожжей и некоторых других полупродуктов. Усиление смачивания водой различных поверхностей широко используется в промышленности в качестве сопутствующего процесса при мойке оборудования, подготовке сырья, обработке полуфабрикатов и т.д. Адсорбция на границе твердое тело — жидкость широко применяется при очистке жидкостей (например, диффузионного сока при производстве сахара, растительных масел и соков) от примесей.
Развитие теории адсорбционных сил еще не достигло такой стадии, когда по известным физико-химическим свойствам газа и твердого тела можно было бы рассчитать изотерму адсорбции, не проводя экспериментальных исследований. Поэтому попыткам описать экспериментальные изотермы с помощью различных теоретических уравнений, которым соответствуют определенные модели адсорбции, посвящено огромное количество работ. Если теоретическое уравнение изотермы адсорбции хорошо воспроизводит экспериментальные данные, то можно рассчитать неизвестные величины адсорбции при разных условиях (р и Т) и определить различные геометрические параметры твердых тел. Рассмотрим лишь немногие, наиболее распространенные теоретические уравнения изотерм адсорбции.
Делись добром 😉
АДСОРБЦИЯ В ПИЩЕВЫХ ПРОИЗВОДСТВАХ
Процесс поглощения одного или нескольких компонентов из смеси газов, паров или жидких растворов поверхностью твердого вещества - адсорбента называется адсорбцией. Процесс адсорбции подобно процессу абсорбции избирателен, т. е. из смеси поглощаются только определенные компоненты. Как и при абсорбции поглощенное вещество может быть выделено из адсорбента, например, при нагревании. Этот процесс регенерации - обновления абсорбента называется десорбцией.
Процессы абсорбции и адсорбции внешне похожи. Разница между ними заключается в том, что в одном случае вещество поглощается всем объемом жидкости, а в другом - только поверхностью твердого поглотителя - адсорбента.
В пищевой промышленности адсорбция применяется при очистке водно-спиртовых смесей в ликеро-водочном производстве, при очистке и стабилизации вин, соков и других напитков. В свеклосахарном производстве адсорбцией обеспечивается основная очистка диффузионного сока в процессе его сатурации, а также обесцвечивание сахарных сиропов перед кристаллизацией.
Равновесие при адсорбции
Количество вещества, поглощенного адсорбентом, зависит от концентрации поглощаемого вещества в парогазовой смеси или растворе, а также от температуры, при которой осуществляется процесс. Условия равновесия для адсорбции
Линии равновесия, соответствующие уравнениям (7.75) и (7.76), получили название изотерм сорбции. Изотермы сорбции (рис. 26) строят по опытным данным. Характер кривой изотермы сорбции зависит от многих факторов, в том числе от удельной поверхности адсорбента, объема пор, структуры и распределения пор, свойств поглощаемого вещества и, конечно, от температуры.
Движущая сила процесса адсорбции определяется как разность между рабочей и равновесной концентрациями поглощаемого вещества в парогазовой или жидкой фазах.
Рабочая линия для непрерывных процессов адсорбции соответствует уравнению (7.6).
В процессе адсорбции происходит выделение теплоты, что ведет к повышению температуры в системе и снижению активности адсорбента. Поэтому для поддержания скорости процесса в промышленных адсорберах предусматривают охлаждение адсорбента.
Адсорбенты
Количество поглощаемого вещества зависит от площади поверхности поглотителя. Поэтому адсорбенты обладают чрезвычайно развитой поверхностью, что достигается за счет образования большого количества пор в твердом теле.
Активированный уголь. Это самый распространенный адсорбент. Его получают сухой перегонкой дерева с последующей активацией - прокаливанием при температуре около 900 °С. Суммарная поверхность 1 г активированного угля 600… 1700 м2. Активированный уголь получают также из костей животных и других углеродсодержащих материалов. Размеры кусков активированного угля в зависимости от марки лежат в пределах от 1 до 5 мм. Активированный уголь лучше поглощает пары органических веществ, чем пары воды. Недостатками активированных углей являются их небольшая механическая прочность и горючесть.
Силикагели. Этот адсорбент получают обезвоживанием геля кремниевой кислоты, обрабатывая силикат натрия (жидкое стекло) минеральными кислотами или кислыми растворами их солей. Размер гранул силикагеля лежит в пределах от 0,2 до 7 мм.
Суммарная поверхность 1 г силикагеля 400…770 м2. Силикагели эффективно поглощают пары органических веществ, а также влагу из воздуха и газов. Поэтому гранулы силикагеля иногда используют при упаковке на хранение приборов и материалов, боящихся влаги. В отличие от активированного угля силикагель негорюч и обладает большой механической прочностью.
Цеолиты. Это пористые водные алюмосиликаты катионов элементов первой и второй групп Периодической системы Д. И. Менделеева. Встречаются в природе и добываются карьерным способом. В промышленности чаще применяют синтетические цеолиты, обладающие весьма однородной структурой, с размерами пор, которые можно сравнить с размерами крупных молекул. Поэтому цеолиты обладают свойствами микрофильтра-ционных мембран.
Цеолиты отличаются высокой поглотительной способностью по отношению к воде и поэтому используются для глубокой осушки газов и воздуха с незначительным содержанием влаги. Гранулы промышленных цеолитов обычно имеют размеры от 2 до 5 мм.
Иониты. Это природные и искусственные адсорбенты, действие которых основано на химическом взаимодействии с очищаемыми растворами. Процессы с применением ионитов следует отнести к хемосорбции - адсорбции, сопровождаемой химическими реакциями. Иониты, содержащие кислые активные группы и обменивающиеся с раствором электролита подвижными анионами, называются анионитами. Иониты, содержащие основные активные группы и обменивающиеся подвижными катионами, называются катионитами. Существует группа аморфных ионитов, способных к анионному и катионному обменам одновременно. Наибольшее распространение в промышленности получили ионообменные смолы. Так, в сахарорафинадном производстве с помощью ионообменных смол осуществляют обесцвечивание сиропов. Смолы применяют также в некоторых случаях при обработке воды. Последние успехи в области синтеза ионитов позволяют надеяться на их успешное использование в нетрадиционных технологиях, например в производстве спирта-ректификата из спирта-сырца.
В качестве естественных адсорбентов в пищевой промышленности, например для осветления вин, используют мелкодисперсные глины: бентонит, диатомит, каолин. С этой же целью применяют рыбий клей (желатин) и другие вещества.
Расчет адсорберов
Порядок расчета адсорберов аналогичен порядку расчета абсорберов. И только фиксированная поверхность массообмена, которую несложно определить, позволяет воспользоваться неко-торыми кинетическими уравнениями и более точно рассчитать требуемые размеры аппарата, не прибегая к определению числа ступеней изменения концентрации.
Материальный баланс. Уравнение материального баланса процесса адсорбции соответствует уравнению (7.3):
Кинетика процесса адсорбции. Процесс поглощения вещества при адсорбции в общем случае описывается критериальным уравнением для систем с твердой фазой:
Количество теплоты, выделяемое при адсорбции. Удельную теплоту адсорбции г (Дж/моль) обычно определяют опытным путем и для разных веществ приводят в справочниках. При отсутствии опытных данных можно воспользоваться следующим уравнением:
Физическая и химическая адсорбция
Адсорбция – поглощение веществ из растворов или газов поверхностным слоем твёрдого тела или жидкости. Движущей силой процесса является наличие на поверхности некомпенсированных сил межатомного взаимодействия, за счёт чего и притягиваются молекулы адсорбированного вещества – адсорбата. Происходит не только снижение поверхностной энергии, но и образование на поверхности различной по составу пленки.
Термодинамическое состояние атомно-чистой поверхности способствует активному протеканию процесса адсорбции. Известно, что на чистой металлической поверхности содержится около 105 адсорбционных позиций, приходящихся на 1 см2.
Различают физическую и химическую адсорбцию веществ на поверхности. Возможны и промежуточные виды взаимодействий на границе раздела фаз.
Физическая адсорбция. Адсорбированный слой связан с поверхностью слабыми межатомными связями, например силами Ван-дер-Ваальса. Теплота физической адсорбции, как правило, невелика и редко превосходит несколько десятков кДж/моль (примерно 40 кДж/моль).
Процесс физической адсорбции обратим, относится к неактивируемым, протекает очень быстро, как только молекулы адсорбата окажутся на поверхности твёрдого или жидкого тела. Наиболее часто физическую адсорбцию связывают с взаимодействием поверхности с газовой фазой. Количество адсорбированного газа снижается при уменьшении давления и возрастании температуры.
Простейшие уравнения мономолекулярной адсорбции предложены Генри и Ленгмю ром. Уравнение Генри (так называемая изотерма Генри)
| , | (2.4) |
где Θ — степенях заполнения молекулами адсорбата однородной поверхности адсорбента, к — коэффициент пропорциональности, зависящий главным образом от температуры и характера взаимодействия адсорбента с адсорбентом, Р — давление, справедливо при очень низких Θ степенях заполнения молекулами адсорбата однородной поверхности адсорбента.
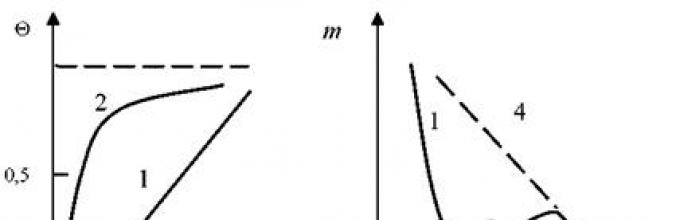
Изотерма Генри представляет собой прямую линию 1 (рисунок 2.1, а). С увеличением давления Р рост адсорбированного мономолекулярного слоя замедляется. Молекула адсорбата испытывает трудности в закреплении на еще не занятом пространстве поверхности адсорбента.

Рисунок 2.1 — Зависимость изменения количества адсорбированного вещества от давления (а) и температуры (б ) (пояснения в тексте)
Изотерма приобретает выпуклый характер 2, а значение в стремится к единице (см. рисунок 2.1, а). Выпуклые изотермы описываются уравнением Ленгмюра
| , | (2.5) |
где а – адсорбционный коэффициент, аналогичный по физическому смыслу константе к в уравнении (2.5).
Следует отметить, что уравнение Ленгмюра справедливо только для мономолекулярной адсорбции на однородной поверхности, возможностью притяжения молекул адсорбата между собой и их подвижностью вдоль поверхности адсорбента пренебрегают. При дальнейшем увеличении давления адсорбата происходит заполнение второго, третьего и других слоев. Процесс переходит в полимолекулярную адгезию.
Поверхность твёрдых адсорбентов в основном неоднородна. Одни участки благоприятны для адсорбции, другие – наоборот. С ростом давления адсорбата полимолекулярная адсорбция происходит одновременно по всей поверхности с различной степенью интенсивности.
Процесс адсорбции почти всегда сопровождается выделением теплоты, которое называют теплотой адсорбции.
Прочность адсорбционного слоя пропорциональна теплоте адсорбции. При переходе к полимолекулярной адсорбции теплота адсорбции приближается к теплоте конденсации адсорбата.
Температурные условия оказывают большое влияние на протекание процесса физической адсорбции. Высокая подвижность молекул на поверхности при повышении температуры приводит к десорбции образующегося слоя. Дальнейшее повышение температуры может переводить физическую адсорбцию в химическую – хемосорбцию, имеющую более прочные связи.
На рисунке 2.1, б приведена качественная зависимость адсорбции газовой среды от температуры при постоянном давлении. При низких температурах изобара 1 описывает физическую адсорбцию. При достижении определенной температуры возможен процесс перехода физической адсорбции к хемосорбции. Происходит рост адсорбируемого вещества (кривая 2). При заполнении всей поверхности адсорбатом снова начинает снижаться количество адсорбированного вещества (кривая 3). Адсорбция в области 1 обратима, а в области 2 необратима. В случае охлаждения системы процесс переходит из области 3 в область 4.
Слабые междуатомные связи на поверхности при физической адсорбции, по-видимому, в малой степени способны уравновесить некомпенсированные связи поверхностных атомов. Соответственно этому не следует ожидать значительного снижения уровня свободной поверхностной энергии. При подготовке поверхности изделий для нанесения покрытий следует учитывать слабые связи физически адсорбированных веществ (твердых, жидких и газообразных).
Химическая адсорбция. Хемосорбция представляет собой процесс поглощения поверхностью жидкого или твердого тела веществ из окружающей среды, сопровождающийся образованием химических соединений. При хемосорбции выделяется значительное количество теплоты. Обычно теплоты хемосорбции лежат в пределах 80–125 кДж/моль.
Физическая и химическая адсорбция
Взаимодействие кислорода с металлами (окисление) даёт значительно более высокие значения теплоты, достигающие 400 кДж/моль.
Подобно химическим реакциям хемосорбция требует для своего протекания значительной энергии активации. Следовательно, при увеличении температуры процесс хемосорбции ускоряется. Происходит так называемая активируемая адсорбция. Хемосорбция относится к избирательным процессам и зависит от химического сродства абсорбента и адсорбата, которое наряду с температурой определяет скорость протекания реакции. Например, при взаимодействии газов с чистыми металлами или металлоподобными поверхностями наблюдается исключительно быстрая хемосорбция, что связано со слабой насыщенностью связями поверхностных атомов. Хемосорбция протекает при минимальных значениях энергии активации. Хемосорбция на твёрдых поверхностях зависит от кристаллографической ориентации зёрен, наличия различных дефектов и др. Хемосорбция начинается на наиболее активных участках поверхности. Принято считать, что хемосорбция происходит до тех пор, пока вся поверхность не покроется мономолекулярным слоем адсорбата. По сравнению с физической адсорбцией хемосорбция чувствительна к давлению окружающей среды.
Наличие на поверхности хемосорбированных пленок в значительной мере уравновешивает некомпенсированные оборванные связи поверхностных атомов. Поверхностная энергия при этом достигает минимальных значений, что следует учитывать при подготовке поверхностей для нанесения покрытий. Для удаления хемосорбированных поверхностных соединений (загрязнений) требуются значительные энергетические воздействия.
ПОСМОТРЕТЬ ЕЩЕ:
ПРОТИВОПОКАЗАНИЯ К ПРИМЕНЕНИЮ АДСОРБЕНТОВ
Любые препараты необходимо принимать по рекомендации врача и следуя инструкции! Основным противопоказанием к приему адсорбентов для кишечника является их индивидуальная непереносимость. Препараты активированного угля не рекомендуется использовать при желудочном кровотечении, язвенных поражениях ЖКТ и др.; препараты лигнина – при нарушении углеводного обмена, анацидном гастрите, склонности к запорам. Необходимо учитывать, что при приеме адсорбирующих средств внутрь может уменьшаться эффективность других лекарственных средств, принимаемых с ними одновременно. Поэтому важно делать интервал между приемом адсорбентов и других препаратов.
Сорбционная очистка
НЕОСМЕКТИН® – АДСОРБЕНТ НОВОГО ПОКОЛЕНИЯ
Современный препарат Неосмектин® способствует устранению диареи различного происхождения, метеоризма, изжоги, вздутия и тяжести в животе. Неосмектин® действует в двух направлениях.
СПОСОБСТВУЕТ УСТРАНЕНИЮ ФАКТОРОВ, ПРОВОЦИРУЮЩИХ РАССТРОЙСТВА ПИЩЕВАРЕНИЯ
Патогенная микрофлора, кишечные газы, токсины иногда являются причиной расстройства пищеварения. Неосмектин® адсорбирует их, способствуя их выведению из организма. Таким образом, препарат способствует устранению не симптомов, а самих факторов, которые могут провоцировать проблемы с пищеварением.
защищает слизистую желудочно-кишечного тракта
Неосмектин® стабилизирует слизистый барьер желудочно-кишечного тракта, создавая на его поверхности защитную пленку, которая предохраняет слизистую от повреждения болезнетворными микроорганизмами и дает ей возможность быстрее восстановиться.
Процесс сорбции представляет собой поглощение одной средой - жидкостью или твердым телом других окружающих сред - веществ, газов или других жидкостей. То вещество, которое поглощает окружающую среду - сорбент . Вещество, газ, или жидкость, которые поглощаются сорбентом, называют сорбатом или сорбтивом.
Явление сорбции подразделяют в зависимости от механизма поглощения одних сред другими на адсорбцию, абсорбцию, хемосорбцию и капиллярную конденсацию.
Адсорбция и абсорбция различаются по тому, каким образом одно вещество распределяется в другом. При абсорбции поглощение и распределение вещества происходит по всему объему жидкого абсорбента. При адсорбции твердый, жидкий или газообразный сорбат скапливается на поверхности раздела фаз адсорбента (на поверхности твердого вещества или жидкости).
- Выделяют физическую адсорбцию, при которой скопление веществ на поверхности адсорбента происходит вследствие неспецифических межмолекулярных сил, не зависящих от природы веществ.
- Хемосорбция (или химическая адсорбция) - это сорбционные процессы, при которых происходят химические превращения между сорбентом и поглощаемым веществом.
- Адсорбция растворенных в жидкости веществ на поверхности твердого сорбента происходит по причине разности межмолекулярных сил на поверхности раздела фаз. При адсорбции выделяют два вида взаимодействия между молекулами
:
- молекулы растворенного вещества взаимодействуют с молекулами или атомами поверхности адсорбента;
- молекулы растворенного вещества взаимодействуют с водой в процессе гидратации.
Понятия статической и динамической сорбции
При статической сорбции поглощаемое вещество в виде газа или жидкости контактирует или перемешивается с неподвижно расположенным сорбентом. Статическая сорбция реализуется в оборудовании с перемешивающими устройствами.
При динамической сорбции через слой сорбента пропускается поглощаемая подвижная жидкая или газообразная фаза. Динамическая сорбция реализуется в аппаратах с псевдоожиженным слоем и фильтрах разного типа.
В зависимости от вида сорбции можно выделить статическую и динамическую активность сорбента. Статическая активность сорбента - это количество поглощенного вещества, отнесенное к единице массы сорбента к моменту достижения равновесия. Условия, при которых достигается равновесие - постоянная температура жидкости и начальная концентрация вещества.
Динамическая активность сорбента определяется либо как время от начала пропускания поглощаемого вещества до его проскока, то есть выхода за слой сорбента, либо как предельное количество вещества, поглощенной на единицу объема или массы сорбента до момента проскока поглощаемого вещества через слой сорбента.
В адсорберах промышленного типа динамическая активность сорбента находится в диапазоне 45-90% .
В реальных условиях сорбционные процессы протекают по динамическому типу, так как это более приемлемо для автоматизации производственного процесса и его непрерывности.
Связь между количеством поглощенного сорбентом вещества и веществом, оставшимся в растворе в момент равновесия, подчиняется закону распределения.
Характеристики, которые влияют на скорость процесса адсорбции :
- концентрация сорбата;
- природа и химическое строение растворенного вещества;
- температура воды;
- вид и свойства адсорбента.
Процесс адсорбции состоит из трех этапов :
- перенос содержащихся в растворе веществ к поверхности зерен адсорбента (к внешнедиффузионной области);
- процесс адсорбции;
- перенос вещества внутри зерен адсорбента (к внутридиффузионной области).
Считается, что адсорбция протекает с большой скоростью и стадия адсорбции не лимитирует скорость процесса. Поэтому в качестве лимитирующей стадии рассматривают либо внешнюю, либо внутреннюю диффузию. Могут быть случаи, когда процесс лимитируют обе диффузионные стадии.
В области внешней диффузии скорость переноса массы вещества зависит от величины турбулентности потока, то есть от скорости течения жидкости.
Интенсивность массопереноса во внутридиффузионной области во многом зависит от характеристик адсорбента - его вида, размера пор, формы и размера зерен, от размера молекул поглощаемого вещества, от коэффициента массопроводности.
Можно выявить условия, при которых очистка сточных вод адсорбцией идет с оптимальной скоростью.
Гидродинамический режим адсорбции должен лимитироваться в области внутренней диффузии. Сопротивление внутридиффузионной области уменьшается при подборе адсорбента с нужной структурой и с уменьшением размеров его зерен.
Приблизительные параметры скорости и диаметра зерна адсорбента принимаются равными 1,8 м/ч и d з = 2,5 мм соответственно. Если диаметр зерен d з меньше рекомендуемого, процесс лимитируется по области внешней диффузии, если больше - во внутридиффузионной области.
Адсорбция
АДСО́РБЦИЯ -и; ж. [от лат. ad- - к и sorbere - поглощать, всасывать]. Поглощение вещества из газа или раствора поверхностным слоем жидкого или твёрдого адсорбента (используется в химии, технике и т.п. для разделения и очистки веществ).
◁ Адсорбцио́нный, -ая, -ое.
адсо́рбция(от лат. ad - на, при и sorbeo - поглощаю), поглощение газов, паров или жидкостей поверхностным слоем твердого тела (адсорбента) или жидкости. Адсорбенты обычно имеют большую удельную поверхность - до нескольких сотен м 2 /г. Физическая адсорбция - результат действия дисперсионных или электростатических сил. Если адсорбция сопровождается химической реакцией поглощаемого вещества с адсорбентом, то она называется хемосорбцией. В промышленности адсорбция осуществляют в специальных аппаратах - адсорберах; применяют для осушки газовой очистки органических жидкостей и воды, улавливания ценных или вредных отходов производства.

АДСО́РБЦИЯ (от лат. ad - на, при и sorbeo - поглощаю), поглощение какого-либо вещества (адсорбата) из газообразной среды или раствора поверхностным слоем жидкости или твердого тела (адсорбентом). Различают два вида адсорбции: физическую и химическую (хемосорбцию (см.
ХЕМОСОРБЦИЯ)
). Менее прочная физическая адсорбция не сопровождается существенными изменениями молекул адсорбата. Она обусловлена силами межмолекулярного взаимодействия (см.
МЕЖМОЛЕКУЛЯРНОЕ ВЗАИМОДЕЙСТВИЕ)
, которые связывают молекулы в жидкостях и некоторых кристаллах и проявляются в поведении сильно сжатых газов.
Существенное отличие физической адсорбции - ее обратимость. При хемосорбции молекулы адсорбата и адсорбента образуют химические соединения. Часто адсорбция обусловлена и физическими и химическими силами, поэтому не существует четкой границы между физической адсорбцией и хемосорбцией.
Явление адсорбции связано с тем, что силы межмолекулярного взаимодействия на грАݐؑƐՠраздела фаз нескомпенсированы, и, следовательно, пограничный слой обладает избытком энергии – свободной поверхностной энергией (см.
ПОВЕРХНОСТНАЯ ЭНЕРГИЯ)
. В результате притяжения поверхностью раздела фаз находящихся вблизи нее молекул адсорбата свободная поверхностная энергия уменьшается, т.е. процессы адсорбции энергетически выгодны. Адсорбция всегда является экзотермическим процессом, т. е. протекает с выделением теплоты адсорбции Hs.
Значения энтальпии (см.
ЭНТАЛЬПИЯ)
физической адсорбции достаточно велики (порядка 10 ккал/моль) из-за слабых атомных взаимодействий. Физическая адсорбция легко обратима, поэтому, например, в случае адсорбции газа, достаточно легко может осуществиться замена адсорбированного слоя газа другим газом. Это явление называется обменной адсорбцией.
Процесс адсорбции заканчивается установлением адсорбционного равновесия между адсорбентом и адсорбатом. Условием равновесия является равенство химических потенциалов обеих фаз. С ростом температуры или давления адсорбата в объеме увеличивается частота попаданий молекул адсорбата на поверхность адсорбента; пропорционально ей возрастает скорость адсорбции и увеличивается равновесное количество адсорбированных молекул. Кривые зависимости равновесной адсорбции от температуры или давления адсорбата называются, соответственно, изобарой и изотермой адсорбции.
Адсорбированные молекулы могут перемещаться по поверхности, совершая при этом колебательные движения, то приближаясь к поверхности, то удаляясь от нее. Время, в течение которого молекула находится на поверхности, называется временем адсорбции. С ростом температуры время адсорбции уменьшается: чем выше температура, тем интенсивнее колебательное движение, и больше вероятность того, что в процессе таких колебаний связь молекулы с поверхностью будет разорвана и молекула покинет поверхность. Процесс, при котором адсорбированные молекулы покидают поверхность, называется десорбция (см.
ДЕСОРБЦИЯ)
. Скоростью адсорбции (десорбции) называется отношение количества молекул, адсорбирующихся (десорбирующихся) за единицу времени, к единице поверхности или массы адсорбента. Если скорости адсорбции и десорбции равны друг другу, устанавливается адсорбционное равновесие. В состоянии равновесия количество адсорбированных молекул остается постоянным сколь угодно долго, если неизменны внешние условия (давление, температура и др.).
В случае контакта поверхности кристалла и жидкого раствора из жидкости на поверхность твердого тела переходят молекулы, находящиеся в растворе. Между их концентрациями в растворе и на поверхности адсорбента устанавливается равновесие. Вещества, адсорбируемые из раствора, называются поверхностно-активными веществами (см.
ПОВЕРХНОСТНО-АКТИВНЫЕ ВЕЩЕСТВА (ПАВ))
(ПАВ). Высокая адсорбируемость ПАВов связана с сильным снижением поверхностного натяжения (см.
ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ)
раствора на данной поверхности по сравнению с поверхностным натяжением чистого растворителя на этой же поверхности. Инактивные вещества повышают поверхностное натяжение и ухудшают адсорбцию.
Если теплота адсорбции сравнима с поверхностной энергией адсорбента, то в процессе адсорбции может существенно меняться кристаллическая структура поверхности твердого тела, причем при физической адсорбции перестройке подвергаются в основном поверхности молекулярных кристаллов, а в случае хемосорбции изменения поверхностной структуры наблюдаются даже для металлов и ионных кристаллов. Адсорбированные на поверхности пленки сильно изменяют свойства поверхности, а в ряде случаев затрагивают и более толстые приповерхностные слои.
Адсорбция играет важную роль во многих природных процессах, таких, как обогащение почв и образование вторичных рудных месторождений. Именно благодаря адсорбции осуществляется первая стадия поглощения различных веществ из окружающей среды клетками и тканями биологических систем, функционирование биологических мембран, первые этапы взаимодействия ферментов с субстратом, защитные реакции против токсичных веществ. Многие адсорбенты (активный уголь, каолин (см.
КАОЛИН)
, иониты (см.
ИОНИТЫ)
и др.) служат противоядиями, поглощая и удаляя из организма вредные вещества. Адсорбенты обычно имеют большую удельную поверхность - до нескольких сотен м 2 /г. В промышленности адсорбцию осуществляют в специальных аппаратах - адсорберах; применяют для осушки газов, очистки органических жидкостей и воды, улавливания ценных или вредных отходов производства.
Энциклопедический словарь . 2009 .
Синонимы :Смотреть что такое "адсорбция" в других словарях:
- (от лат. ad на, при и sorbeo поглощаю), процесс, приводящий к аномально высокой концентрации в ва (а д с о р б а т а) из газообразной или жидкой среды на поверхности её раздела с жидкостью или тв. телом (а д с о р б е н т о м). Частный случай… … Физическая энциклопедия
Поглощение поверхностью фазово инородного тела (адсорбента) каких либо веществ (адсорбатов) из смежной газовой или жидкой среды, протекающее на границе раздела фаз. А. из газовой фазы или из растворов нашла… … Геологическая энциклопедия
- (от лат. ad на при и sorbeo поглощаю), поглощение газов, паров или жидкостей поверхностным слоем твердого тела (адсорбента) или жидкости. Адсорбенты обычно имеют большую удельную поверхность до нескольких сотен м²/г. Физическая адсорбция… … Большой Энциклопедический словарь
адсорбция - Самопроизвольное изменение концентрации раствора или газовой смеси вблизи поверхности раздела фаз. Примечание Адсорбирующее твердое тело называется адсорбентом, адсорбируемое вещество адсорбатом. [ГОСТ 17567 81] адсорбция Удерживание физическими… … Справочник технического переводчика
Адсорбция - – поглощение газов, паров или жидкостей поверхностным слоем твердого тела (адсорбента) или жидкости. [Терминологический словарь по бетону и железобетону. ФГУП «НИЦ «Строительство» НИИЖБ и м. А. А. Гвоздева, Москва, 2007 г. 110 стр.]… … Энциклопедия терминов, определений и пояснений строительных материалов
- (от лат. ad на и sorbeo поглощаю) поглощение различных веществ из растворов или воздушной среды поверхностями твердых тел. Может быть физической или химической (с образованием химических соединений), чаще всего сопровождается выделением тепла.… … Экологический словарь
Поглощение вещества из раствора или газа поверхностным слоем жидкости или твердого тела (адсорбентом); играет важную роль в биол. системах, широко применяется в биохимии для разделения и очистки веществ. (Источник: «Микробиология: словарь… … Словарь микробиологии
адсорбция - и, ж. adsorption f. <лат. ad при + sorbere поглощать, всасывать. спец. Поглощение, всасывание вещества из раствора или газа поверхностью твердого тела или поверхностным слоем жидкости. Явления адсорбции. Адсорбция газов. Работы по изучению… … Исторический словарь галлицизмов русского языка
адсорбция - – самопроизвольное изменение концентрации растворенного вещества на границе раздела фаз. Общая химия: учебник / А. В. Жолнин Адсорбция – поглощение вещества поверхностью твердого или жидкого сорбента. Словарь по аналитической химии … Химические термины
- (от латинского ad на, при и sorbeo поглощаю), поглощение газов, паров или жидкостей поверхностным слоем твердого тела (адсорбента) или жидкости. В промышленности адсорбцию осуществляют в аппаратах адсорберах. На адсорбции основаны осушка газов,… … Современная энциклопедия
АДСОРБЦИЯ, притяжение газа или жидкости к поверхности твердого тела или жидкости, в отличие от абсорбции, при которой подразумевается проникновение одного вещества в другое (как, например, губка пропитывается водой). Количество адсорбируемого… … Научно-технический энциклопедический словарь
Книги
- Адсорбция , Ягодовский Виктор Дмитриевич , В учебном пособии, написанном профессором РУДН, излагаются теоретические основы адсорбции - сложного явления на границе раздела фаз газ-твердое тело, газ-жидкость, жидкость-твердое тело,… Категория: Химические науки Серия: Учебник для высшей школы Издатель:
Адсорбция является универсальным методом, позволяющим практически полностью извлечь примесь из газовой или жидкой среды. В химической промышленности, в частности в ТНВ, адсорбционный метод широко используется для гладкой очистки и осушки технологических потоков, улучшения качества сырья и продуктов и является одним из методов защиты окружающей среды.
Адсорбция – это концентрирование веществ на поверхности или в объеме твердого тела. В процессе адсорбции участвуют как минимум два компонента. Твердое вещество, на поверхности или в объеме которого происходит концентрирование поглощаемого вещества, называется адсорбентом . Поглощаемое вещество, находящееся в газовой или жидкой фазе называется адсорбтивом , а после того, как оно перешло в адсорбированное состояние – адсорбатом . Любое твердое вещество обладает поверхностью, и следовательно, потенциально является адсорбентом. Однако, в технике используют твердые адсорбенты с развитой внутренней поверхностью. Развитие внутренней поверхности в твердом теле достигается путем создания специальных условий в процессе его синтеза или в результате дополнительной обработки.
С термодинамической точки зрения адсорбция проявляется с уменьшением свободной энергии Гиббса (G). Как и все процессы, сопровождающие уменьшением энергии Гиббса, адсорбция является самопроизвольным процессом. Переход вещества из газовой или жидкой фазы в адсорбированное состояние связан с потерей по меньшей мере одной степени свободы, (трехмерная объемная газовая или жидкая фаза двухмерная поверхностная фаза), что ведет к уменьшению энтропии системы (S). Поскольку энтальпия (Н) связана с энергией Гиббса и энтропией уравнением Н = G + TS, то в процессе адсорбции она убывает, и следовательно, адсорбция – процесс экзотермический.
Адсорбционные явления делят на два основных типа: физическую адсорбцию и хемосорбцию (сорбцию, основанную на силах химического взаимодействия). Физическая адсорбция вызывается силами молекулярного взаимодействия: дисперсионными и электростатическими. Дисперсионные силы вносят основной вклад в энергию взаимодействия молекул. Так, молекулы любого адсорбтива обладают флуктуирующими диполями и квадруполями, вызывающими мгновенные отклонения распределения электронной плотности от среднего распределения. При сближении молекул адсорбтива с атомами или молекулами адсорбента движение флуктуирующих диполей приобретает систематический и строго упорядоченный характер, что приводит к возникновению притяжения между ними. В ряде случаев дисперсионные силы усиливаются электростатическими силами – ориентационными и индукционными. Ориентационные силы возникают при взаимодействии полярных молекул с поверхностью, содержащей, электростатические заряды (ионы, диполи), а индукционные – вызываются изменением электронной структуры молекул адсорбтива и адсорбента под действием друг друга.
В отличие от физической адсорбции, при хемосорбции не сохраняется индивидуальность адсорбтива и адсорбента. При сближении молекул адсорбтива с поверхностью адсорбента происходит перераспределение электронов взаимодействующих компонентов с образованием химической связи. Если физическую адсорбцию можно сравниь с конденсацией, то хемосорбция рассматривается как химический процесс, протекающий на поверхности раздела фаз.
Физическую адсорбцию и хемосорбцию можно отличить на основании численного значения теплоты адсорбции. Теплота адсорбции компонентов промышленных газов соизмерима с теплотой их конденсации и не превышает 85-125 кДж/моль. Теплота хемосорбции одного моля вещества достигает нескольких сотен кДж. Хемосорбция, как правило, протекает с небольшой скоростью, это обстоятельство часто используется для ее распознания. Кроме того, хемосорбция может протекать при высоких температурах, когда физическая адсорбция пренебрежимо мала. При хемоморбции характерным является резкое, скачкообразное изменение поглотительной способности по извлекаемому компоненту при переходе от адсорбента одной химической природы к адсорбенту другой природы. При хемосорбции адсорбированные молекулы не могут перемещаться по поверхности адсорбента, их положение фиксировано, и такая адсорбция называется локализованной. Физическая адсорбция может быть как локализованной, так и не локализованной. Обычно, при повышении температуры молекулы приобретают подвижность и характер процесса изменяется: локализованная адсорбция переходит в нелокализованную.